- 服務
- ·
DRUG-seq
- 產(chǎn)品介紹
- 案例解析
- 結(jié)果展示
- 送樣建議
- FAQ
服務介紹
DRUG-seq,全稱Digital RNA with pertUrbation of Genes (DRUG)-seq,即高通量藥物篩選RNA測序。該技術是針對在96/384孔板上的微量細胞,通過孔標簽及UMI定量技術進行全長擴增的轉(zhuǎn)錄組測序技術,是CMC申報流程中前期藥物篩選的重要環(huán)節(jié)。在進行數(shù)百種候選藥物和實驗條件的高通量篩選時,實現(xiàn)全部樣本的轉(zhuǎn)錄組同時檢測,獲取豐富的藥物作用信息。Drug-seq可以利用精準分析表達譜,從而定位藥物影響細胞的特異代謝途徑,同步揭示用藥后細胞轉(zhuǎn)錄水平的變化,全面、深入地評估候選藥物,提升藥物發(fā)現(xiàn)的效率和成功率。

DRUG-seq技術路線圖
DRUG-seq應用
1. 確定化合物作用機理:驗證已知靶點化合物作用機理,或推測未知靶點化合物的可能的作用機理;
2. 研究不同化合物對間接靶點的劑量動力學差異;
3. 評估不同化合物引起的生物功能差異;
4. 評價化合物作用于非靶基因引起的生物功能等。
測序方案
測序模式:Illumina Novaseq
測序數(shù)據(jù)量:1-2G/well
Drug-seq技術優(yōu)勢
1.通量高:可一次性獲得96或384孔板所有孔細胞內(nèi)轉(zhuǎn)錄組水平的基因表達情況;
2.周期短:同時進行96孔或384孔樣本的實驗,實驗周期短至20個工作日;
3.成本低:96孔或384孔樣本合并建庫測序,成本遠低于傳統(tǒng)RNA-seq;
4.起始量少:細胞起始量在2,000~20,000均可實驗;
5.分辨率更高:相比傳統(tǒng)藥物高通量篩選技術針對于細胞表型,基于RNA測序的Drug-seq藥物篩選技術可以針對基因?qū)用妫?/span>
6.生信分析全面:可做標準化分析,也可根據(jù)要求定制分析;基于基因差異表達的分析,既可定位至藥物影響下細胞的特異代謝途徑,又可以同步揭示藥物的其他作用效應,獲取多維的藥物作用信息,全面評估藥物的作用機制。
研究對8個劑量的433種化合物進行概念驗證實驗中,由DRUG-seq技術獲得的轉(zhuǎn)錄譜成功地根據(jù)其預期靶點的作用機制(MoAs)將化合物進行功能分類。在涉及相同靶標的化合物中檢測到反映在轉(zhuǎn)錄組變化中的擾動差異,證明了使用DRUG-seq了解靶標上和脫靶活性的價值。[1]
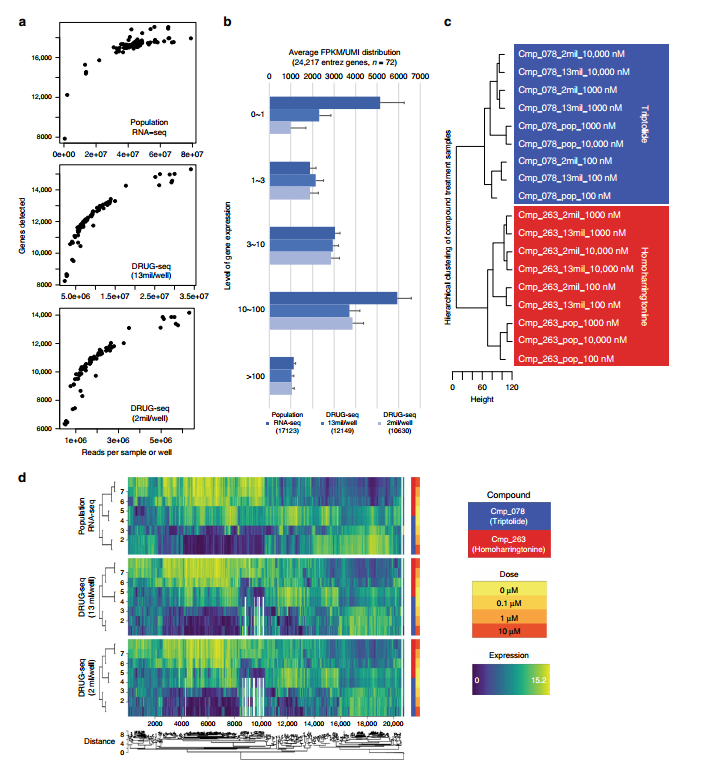
圖1. DRUG-seq的性能與標準RNA-seq相當
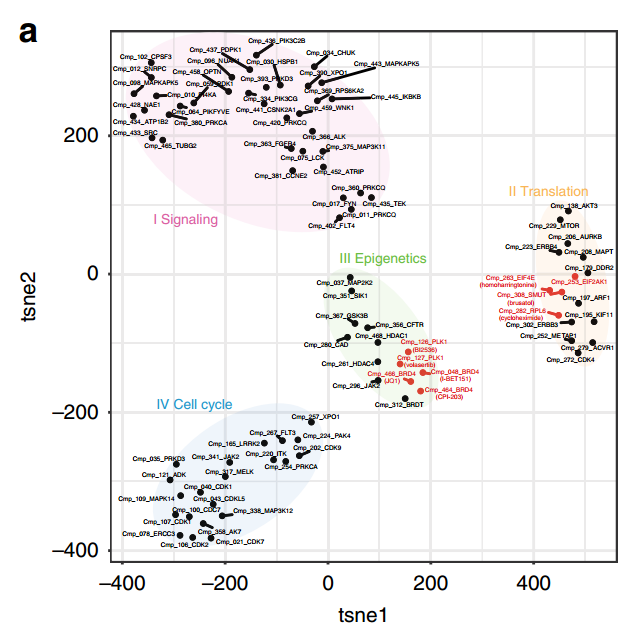
圖2. 化合物與調(diào)控機制的tSNE聚類分析
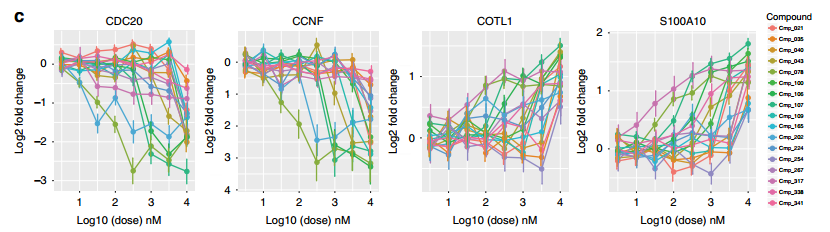
圖3. 不同濃度化合物處理后,具體基因的表達變化
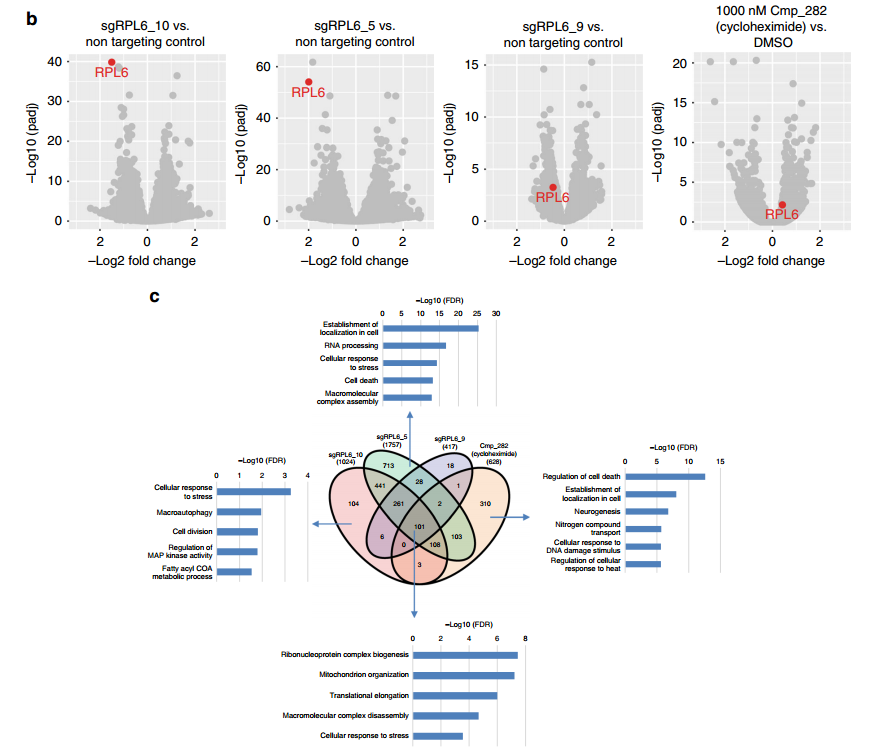
圖4. 化合物處理后,差異基因表達分析
參考文獻
[1] Ye C, Ho DJ, Neri M, et al. DRUG-seq for miniaturized high-throughput transcriptome profiling in drug discovery. Nat Commun. 2018, 9(1):4307. doi: 10.1038/s41467-018-06500-x.
生物信息分析
基礎分析
1. 原始數(shù)據(jù)質(zhì)控檢查
2. 比對結(jié)果質(zhì)控檢查
3. 基因表達定量分析
4. 樣品主成分分析
5. 樣品與基因聚類分析
6. 差異基因表達分析
7. 差異基因GO功能分析
8. 差異基因KEGG通路分析
9. 差異基因Rectome通路分析
10. 差異基因GSEA富集分析
個性化分析
1. 相關基因互作分析(藥物處理后,與疾病相關的所有基因及其相互作用關系)
2. 基因共表達分析(藥物處理后,與疾病相關的所有基因及其相互作用關系)
3. 趨勢分析(不同藥物濃度處理的基因表達變化,藥物處理后不同時間段的變化——時序分析)
(其他定制化分析請詳詢)
Table. Drug-seq樣本送樣建議
送樣類型
送樣量
操作參考
寄送方法
貼壁細胞
2000-10000 cells
50-100μL PBS 洗滌細胞兩遍, 徹底去除PBS后,加30uL Lysis Mix,室溫吹打裂解 6 min
液氮速凍,-80℃保存,干冰寄送,裂解物不要凍融,處理后當天寄出
懸浮細胞
2000-10000 cells
細胞培養(yǎng)懸液吹打混勻,每孔取出10uL,按照1:1加入Lysis Mix(10μL),混勻室溫裂解 6 min
液氮速凍,-80℃保存,干冰寄送,裂解物不要凍融,處理后當天寄出
*更具體的送樣方法請詳詢銷售或技術支持
1.該產(chǎn)品可同時完成96例樣本的混合建庫,如何獲得對應樣本的序列信息?
答:通過特定的樣本標簽well barcode以及UMI定量技術,在96孔板中進行不同樣本的mRNA標記,標記完成的cDNA可以混合在一起,構(gòu)建1個混樣的NGS文庫。NGS測序后通過barcode序列識別空標簽,并將well barcode和UMI信息拆分還原到96孔板的不同樣本。在取用樣本標簽時,應注意標記每孔所對應的UMI各孔編號,否則導致該孔對應轉(zhuǎn)錄組文庫信息無法正確拆分。
2.每孔樣本標簽UMI可以反復使用嗎?
答:每孔對應的樣本標簽well barcode和UMI只能使用一次,避免反復使用出現(xiàn)交叉污染。使用樣本標簽時,冰上融化后震蕩混勻離心后用槍頭扎破使用,切勿撕掉膜使用。
3.試劑盒適用于什么其實材料?
答:新鮮細胞和凍存細胞(推薦細胞投入量:5k~30k/well),Total RNA(推薦投入量20ng~100ng/well)
4.細胞裂解和RNA捕獲時,裂解的時間對獲得cDNA的影響?
答:為了獲得質(zhì)控較好的cDNA,按照實驗要求時間操作,裂解時間過長時,RNA容易降解,后續(xù)cDNA中小片段占比高。
5.混合建庫測序時,是否有推薦的測序量?
答:推薦測序數(shù)據(jù)量:1G/well
填寫需求描述給我們
工具快速咨詢
400-8989-400
geneseed@geneseed.com.cn

 購物車
購物車




 廣州市黃埔區(qū)開源大道11號科技企業(yè)加速器A區(qū)6棟2樓
廣州市黃埔區(qū)開源大道11號科技企業(yè)加速器A區(qū)6棟2樓


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn