- 產品
- ·
circRNA過表達載體
- 產品介紹
- 案例分析
- 客戶文章
- 說明書下載
- Q&A
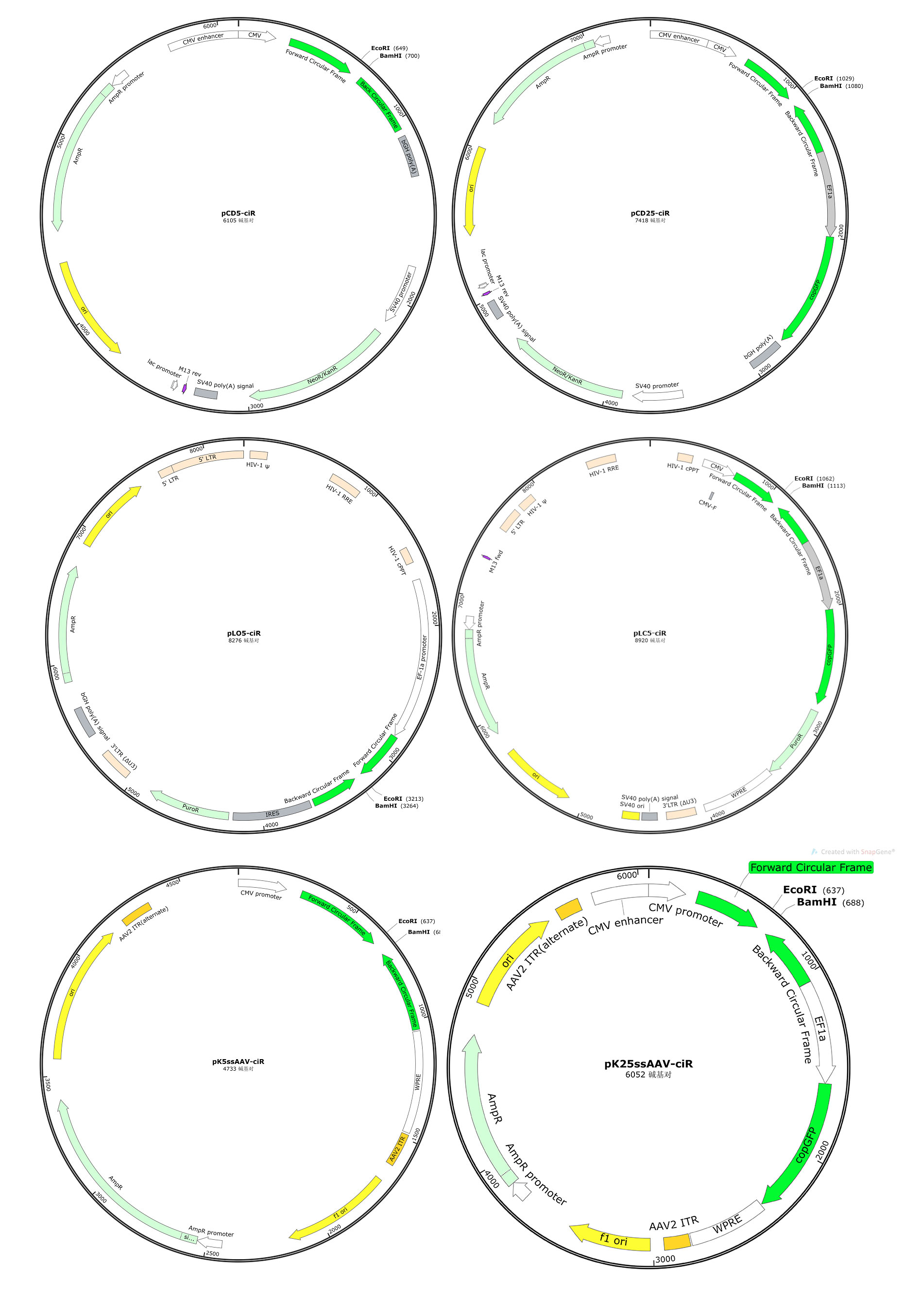
第五代circRNA過表達載體有pCD5-ciR、pCD25-ciR、pLO5-ciR、pLC5-ciR、pK5ssAAV-ciR和pK25ssAAV-ciR,能滿足普通真核表達、慢病毒包裝和腺相關病毒(AAV)包裝等多種用途。載體均攜帶優化過的側翼成環框架,含有精心改造的Alu元件、QKI等RBP的結合位點,并使用全新設計的環化介導序列,能保證插入的circRNA準確高效環化。
第五代circRNA過表達載體的主要特點
1.環化準確性更高。全新設計的成環框架和環化介導序列,在保證高效率過表達的前提下環化準確性更高,比上代載體準確環化成功率提高60%。
2.穩定性更高。對長度小于200 nt或大于2000 nt的circRNA準確高效過表達成功率更高,比上代載體成功率提高30%。
3.通用性更強。提升對非天然circRNA序列的支持,插入任意一段序列也可以準確高效成環,比上代載體成功率提高50%。
4.可移植性更高。6個載體全部預留最常用的EcoRI和BamHI酶切位點,不同載體間轉換更方便。
無GFP GFP 真核表達載體 GENESEED?pCD5-ciR GENESEED?pCD25-ciR 只瞬時表達 慢病毒表達載體 GENESEED?pLO5-ciR GENESEED?pLC5-ciR 可穩定/瞬時表達 AAV表達載體 GENESEED?pK5ssAAV-ciR GENESEED?pK25ssAAV-ciR 可穩定/瞬時表達 吉賽推出了升級的第五代circRNA過表達載體,有pCD5-ciR、pCD25-ciR、pLO5-ciR、pLC5-ciR、pK5ssAAV-ciR和pK25ssAAV-ciR,使用時只需要克隆circRNA的序列(線性化)進載體中,和常規的載體構建一模一樣,相對簡便省事。能滿足普通真核表達、慢病毒包裝和腺相關病毒(AAV)包裝等多種用途,優點有環化準確性更高、穩定性更高、通用性更強和可移植性更高。
案例1

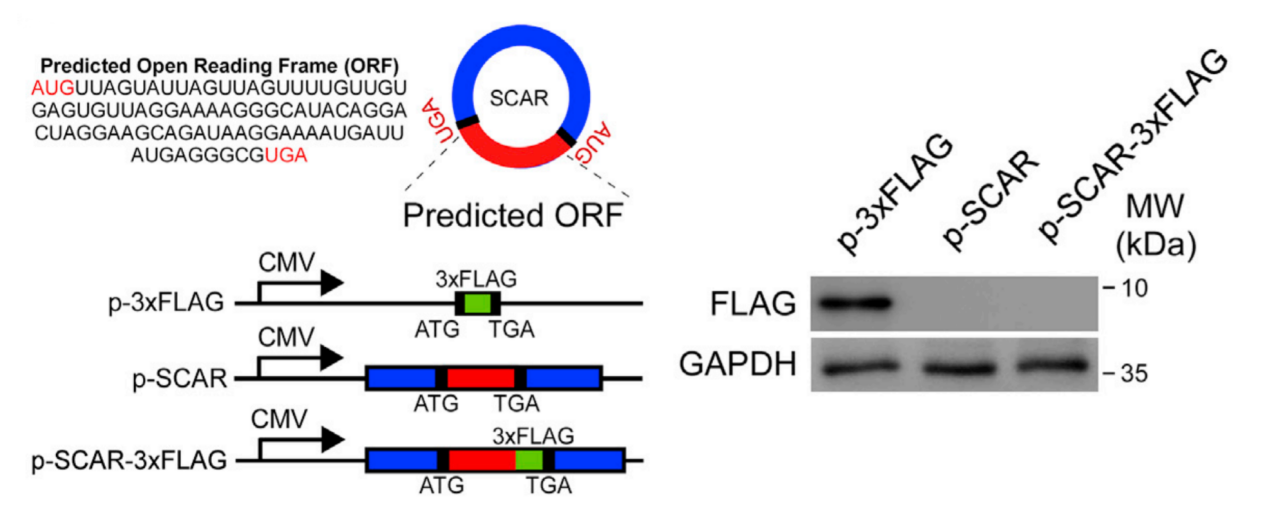
2020年9月14日,中山大學孫逸仙紀念醫院蘇士成教授合作團隊在Cell雜志(IF 41.584)上發表了題為Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output的文章,該文章應用Arraystar Human CircRNA芯片篩選鑒定出與非酒精性脂肪性肝炎發生相關的環狀RNA分子SCAR,并發現在線粒體中過表達circRNA SCAR能夠抑制肝臟成纖維細胞的活化與相應的炎癥反應,敲低則有相反的表型。并且作者使用吉賽公司過表達載體 pcD-ciR 通過插入3×flag標簽以及預測的ORF序列(圖1),發現circRNA SCAR無法編碼蛋白質,隨后作者通過一系列實驗發現該circRNA能夠直接與ATP5B結合并發揮生物學功能[1]。作者團隊發現了線粒體circRNA的重要功能并發展了一系列相關的實驗方法,為免疫代謝疾病提供了一種有吸引力的治療策略。
案例2
南京醫科大學王美林教授,杜牧龍副教授和劉凌翔主任醫師共同通訊在Molecular Cancer雜志在線發表文章Exosomal circLPAR1 functions in colorectal cancer diagnosis and tumorigenesis through suppressing BRD4 via METTL3–eIF3h interaction,本研究強調了血漿外泌體中的circLPAR1在結直腸癌診斷中是一個有前途的預測因子,并描述了其對結直腸癌發生的生物學調節。為臨床早期診斷和疾病發展的發病機制研究提供了新的視角。

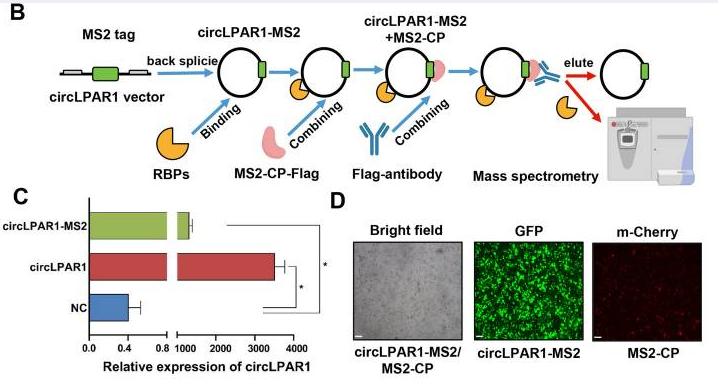
圖1. 使用 MS2 標記系統的 circLPAR1 下拉實驗
本研究中,作者使用circRNA pull-down技術進行circRNA下拉試驗,進而對下拉蛋白產物進行質譜分析。CircRNA pull-down技術是使用帶有MS2捕獲蛋白(MS2-CP)的circRNA下拉分析來確定與circLPAR1相關的RNA結合蛋白(RBPs)。如圖2所示,該技術是在吉賽生物專利技術circRNA過表達載體基礎上,將RNA標簽體系引入circRNA中,通過RNA標簽和捕獲蛋白的高度特異且穩定相互作用,進行靶分子捕獲和相互作用分子的捕獲。[2]
案例解析參考文獻:
[1] Qiyi Zhao, Jiayu Liu, Hong Deng, et al. Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output.Cell (2020), https://doi.org/10.1016/j.cell.2020.08.009
[2] Shanyue Tan, et al. Exosomal circLPAR1 functions in colorectal cancer diagnosis and tumorigenesis through suppressing BRD4 via METTL3–eIF3h interaction Mol Cancer.(2022); doi: 10.1186/s12943-021-01471-y
1、Qiyi Zhao, Jiayu Liu, Hong Deng, et al. Targeting Mitochondria-Located circRNA SCAR Alleviates NASH via Reducing mROS Output.Cell (2020), https://doi.org/10.1016/j.cell.2020.08.009
2、Rui Zheng,#1,2 Ke Zhang,#3 Shanyue Tan, et al. Exosomal circLPAR1 functions in colorectal cancer diagnosis and tumorigenesis through suppressing BRD4 via METTL3–eIF3h interaction Mol Cancer.( 2022); doi: 10.1186/s12943-021-01471-y
-
1、circRNA過表達怎么做?
CircRNA的形成和線性RNA不同,因此對circRNA的過表達不能直接將序列連接到常規的真核表達載體(如pcDNA3.1)來進行。已明確的circRNA形成依賴于側翼序列中的反向互補序列(RCMs,如Alu元件)或與能調控circRNA生成的蛋白(如QKI)的結合位點,因此構建載體時可以在circRNA序列上下游分別增加一段反向互補的序列,質粒轉染細胞后會先轉錄出上游+circRNA+下游的線性RNA鏈,再依靠長下游的反向互補配對促使成環。
2、 circRNA過表達成功標準?
載體構建好后瞬時轉染細胞進行RT-PCR檢測以驗證過表達效率。
1)qPCR檢測有過表達倍數,質粒瞬轉效率高,基因本底豐度不太高的話一般都可以過表達50倍以上;
2)使用Divergent引物檢測過表達的PCR產物是大小正確的單一條帶,PCR產物進行sanger測序確定成環序列準確。滿足這兩個條件才可以認為載體實現了對circRNA的準確高效率過表達。
填寫需求描述給我們
工具快速咨詢
400-8989-400
geneseed@geneseed.com.cn
- 返回頂部

 購物車
購物車




 廣州市黃埔區開源大道11號科技企業加速器A區6棟2樓
廣州市黃埔區開源大道11號科技企業加速器A區6棟2樓


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn