- GENESEED

- 首頁(yè)
- >
- GENESEED
- >
題-1_畫(huà)板 1_20240725111233A339.jpg)
circRNA是由前體RNA通過(guò)反向剪接(back-splicing)形成的,無(wú)5'-端帽子和3'-端poly (A)尾巴的共價(jià)閉環(huán)單鏈RNA。大量研究證明circRNA在病理和生理過(guò)程中起重要作用,circRNA具有作為生物標(biāo)記物、治療靶點(diǎn)和新藥物的潛力。此外,circRNA因獨(dú)特的閉環(huán)結(jié)構(gòu)而穩(wěn)定性更強(qiáng),作為線性mRNA的有效替代品,是下一代RNA療法開(kāi)發(fā)的理想平臺(tái)。因此,circRNA在癌癥等多種疾病中的研究備受關(guān)注。
吉賽生物是引領(lǐng)circRNA科學(xué)研究與應(yīng)用轉(zhuǎn)化的先行者,聚焦circRNA細(xì)分領(lǐng)域十余年,依托強(qiáng)大的原研開(kāi)發(fā)能力,建立合成生物學(xué)、分子生物學(xué)、測(cè)序及生信等多個(gè)技術(shù)平臺(tái),可為廣大科研人員提供全流程的circRNA研究解決方案。


① RNA-seq或circRNA-seq(Nanopore circRNA全長(zhǎng)測(cè)序)分析目標(biāo)樣本,篩選特定表型或疾病中表達(dá)有明顯差異的circRNA;
② 聯(lián)合數(shù)據(jù)庫(kù)生信分析結(jié)果,得到有潛在研究?jī)r(jià)值候選circRNA。
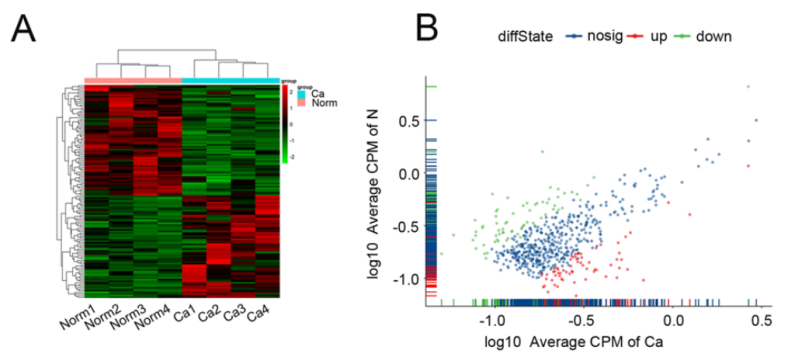
圖1 circRNA-seq得到熱圖和散點(diǎn)圖結(jié)果顯示宮頸癌(CC)組織中存在數(shù)百個(gè)circRNA表達(dá)差異[1]
③ 針對(duì)編碼circRNA的研究,可聯(lián)合翻譯組測(cè)序Ribo-seq或RNC-seq及生信分析,挖掘潛在可翻譯的RNA,并預(yù)測(cè)IRES元件和ORF序列。
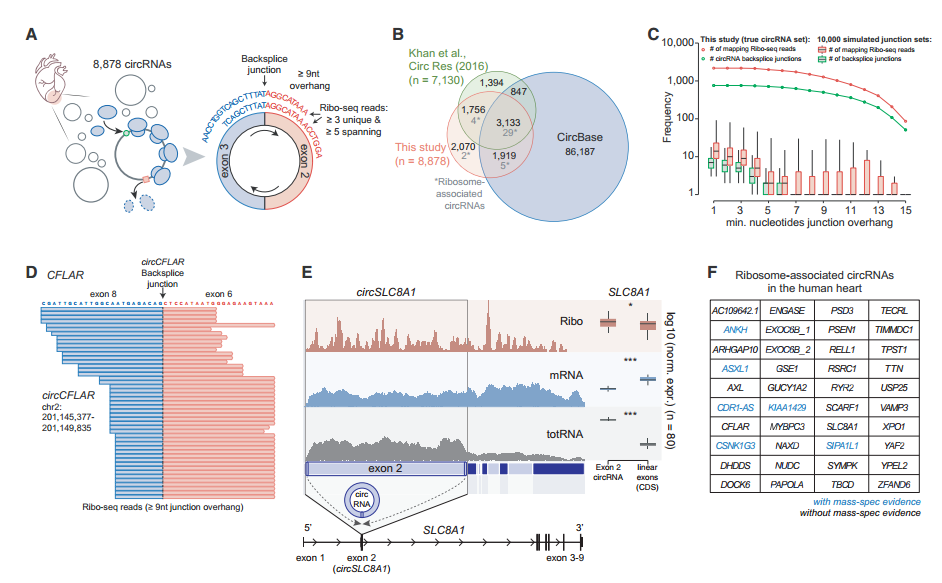
圖2 ribo-seq分析人類心臟循環(huán)的可翻譯circRNA。[2]
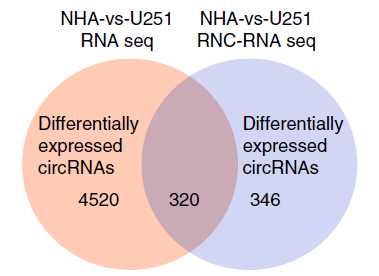
圖3 RNA-seq聯(lián)合RNC-seq篩選膠質(zhì)瘤細(xì)胞中差異表達(dá)的可翻譯circRNA。[3]
相關(guān)技術(shù)服務(wù):
轉(zhuǎn)錄組測(cè)序:Nanopore circRNA全長(zhǎng)測(cè)序、circRNA-seq、RNA-seq
生物信息學(xué):生物醫(yī)學(xué)大數(shù)據(jù)挖掘分析、circRNA定制化分析及繪圖、常規(guī)組學(xué)及多組學(xué)聯(lián)合分析、單細(xì)胞測(cè)序數(shù)據(jù)生信分析
相關(guān)產(chǎn)品:
提取與純化:總RNA提取試劑(Trizol)、液體樣品總RNA提取試劑(Trizol LS)、外泌體提取試劑盒
測(cè)序建庫(kù):Taqman探針?lè)ㄖгw檢測(cè)試劑盒(UNG防污染版)、RNA-seq文庫(kù)構(gòu)建試劑盒、核糖體RNA去除試劑盒 (人/大鼠/小鼠)(植物)

① 內(nèi)源豐度:qRT-PCR驗(yàn)證候選circRNA在目標(biāo)樣品中的內(nèi)源豐度。篩選對(duì)比樣品中表達(dá)量有明顯差異,且內(nèi)源豐度合適的circRNA進(jìn)行下一步驗(yàn)證。
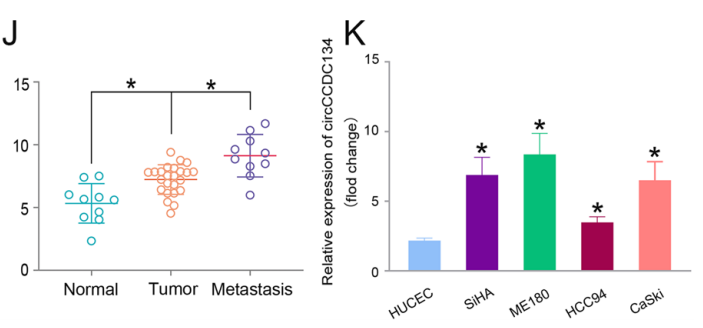
圖4 qRT-PCR結(jié)果顯示,circCCDC134在24個(gè)腫瘤組織和10個(gè)轉(zhuǎn)移組織和CC細(xì)胞中過(guò)表達(dá)[1]
② 環(huán)狀結(jié)構(gòu):設(shè)計(jì)circRNA引物進(jìn)行PCR和Sanger測(cè)序,結(jié)合RNase R耐受實(shí)驗(yàn)鑒定候選分子的環(huán)狀RNA結(jié)構(gòu)。
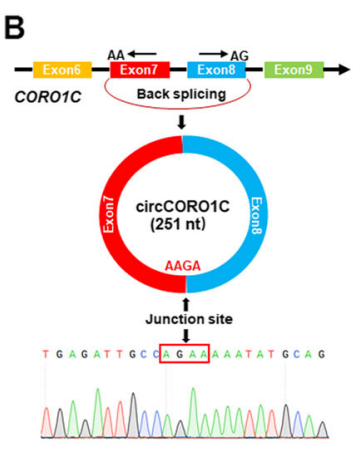
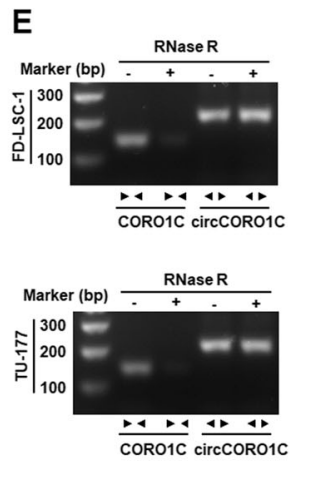
圖5 鑒定circCORO1C環(huán)狀結(jié)構(gòu)。
B:RT-PCR和Sanger測(cè)序驗(yàn)證circCORO1C的反向剪接連接;
E:RNase R處理和RT-PCR分析驗(yàn)證FD-LSC-1和TU-177細(xì)胞中circCORO1C的穩(wěn)定性。[4]
③ 作用定位:熒光原位雜交(FISH)實(shí)驗(yàn)分析候選circRNA主要富集于細(xì)胞核還是細(xì)胞質(zhì)。
不同定位的circRNA的功能和機(jī)制類型可能不同,還會(huì)影響后續(xù)的基因敲低策略的選擇。
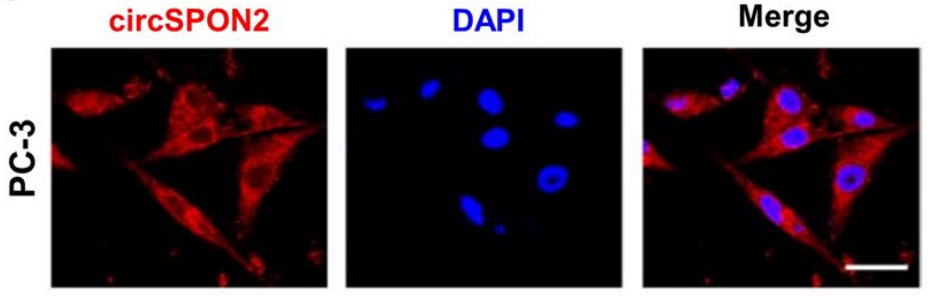
圖6 用Cy3標(biāo)記的circSPON2探針(紅色)進(jìn)行FISH檢測(cè),顯示circSPON2在PC-3細(xì)胞質(zhì)中富集。[5]
相關(guān)技術(shù)服務(wù)
表達(dá)量分析:引物合成及驗(yàn)證
結(jié)構(gòu)鑒定:circRNA成環(huán)驗(yàn)證和全長(zhǎng)鑒定 、RNase R耐受實(shí)驗(yàn)
定位分析:熒光原位雜交(FISH)
相關(guān)產(chǎn)品
提取與純化:總RNA提取試劑(Trizol)、液體樣品總RNA提取試劑(Trizol LS)
表達(dá)量分析:qRT-PCR試劑盒
結(jié)構(gòu)鑒定:RNase R
定位分析:原位雜交試劑盒

① 在目標(biāo)細(xì)胞中過(guò)表達(dá)或敲低候選circRNA。
過(guò)表達(dá)的方式:轉(zhuǎn)染體外制備的circRNA、瞬轉(zhuǎn)circRNA質(zhì)粒、利用病毒載體構(gòu)建circRNA過(guò)表達(dá)的穩(wěn)轉(zhuǎn)細(xì)胞株等。
敲低的方式:轉(zhuǎn)染siRNA、ASO、瞬轉(zhuǎn)shRNA載體、利用病毒載體構(gòu)建circRNA敲低的穩(wěn)轉(zhuǎn)細(xì)胞株等。
敲低細(xì)胞質(zhì)富集的circRNA可用siRNA和shRNA,敲低細(xì)胞核富集的circRNA可用ASO。
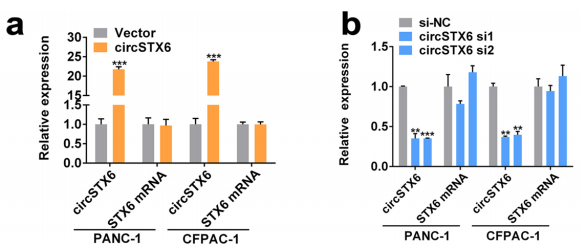
圖7 qRT-PCR分析circSTX6敲低和過(guò)表達(dá)PANC-1和CFPAC-1細(xì)胞中circSTX6和線性STX6的表達(dá)。[6]
② 檢測(cè)細(xì)胞增殖、周期、凋亡、遷移和侵襲,體外驗(yàn)證circRNA的功能。
候選circRNA可影響細(xì)胞功能,則可進(jìn)一步研究作用機(jī)制;對(duì)細(xì)胞功能無(wú)影響,則考慮重新篩選circRNA。
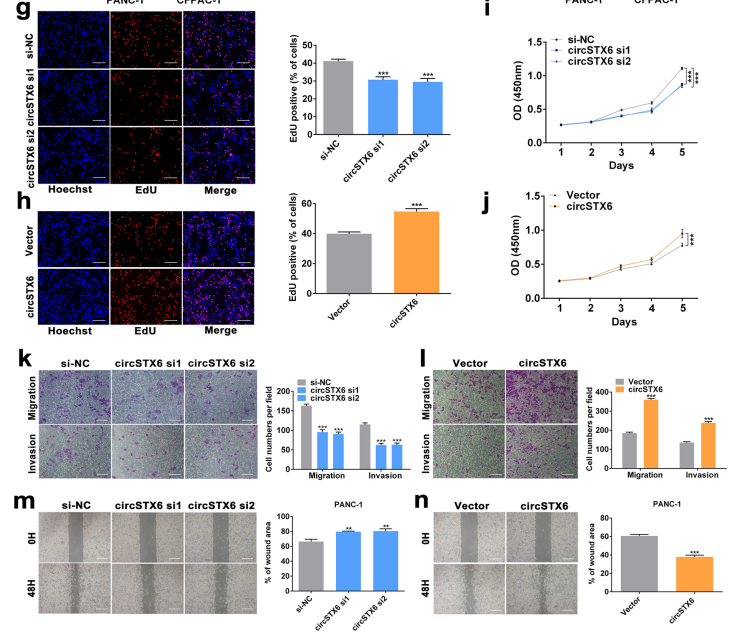
圖8 通過(guò)EdU、CCK8、Transwell等細(xì)胞實(shí)驗(yàn)驗(yàn)證circSTX6的功能。[6]
相關(guān)技術(shù)服務(wù)
過(guò)表達(dá)/敲低:circRNA體外合成-LNP包封、circRNA過(guò)表達(dá)/敲低載體構(gòu)建及驗(yàn)證、慢病毒(LV)/腺相關(guān)病毒(AAV)包裝、穩(wěn)株構(gòu)建、siRNA/ASO設(shè)計(jì)、合成及驗(yàn)證
細(xì)胞功能驗(yàn)證:細(xì)胞功能實(shí)驗(yàn)

細(xì)胞質(zhì)定位的circRNA可能通過(guò)ceRNA、與蛋白互作、編碼蛋白等機(jī)制發(fā)揮作用;而細(xì)胞核定位的circRNA可能通過(guò)與DNA或轉(zhuǎn)錄因子互作調(diào)控轉(zhuǎn)錄。
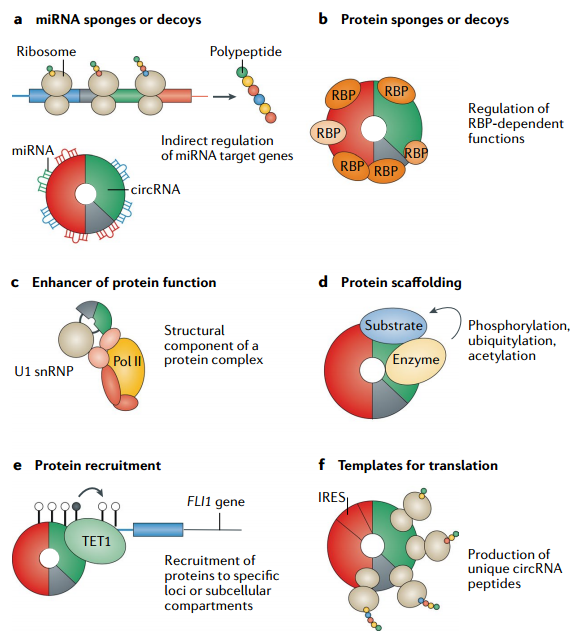
圖9 circRNA功能的一般機(jī)制[7]
(1)ceRNA(competing endogenous RNAs,內(nèi)源競(jìng)爭(zhēng)RNA)機(jī)制
miRNA可通過(guò)結(jié)合mRNA導(dǎo)致基因沉默,而部分circRNA可作為miRNA sponge競(jìng)爭(zhēng)性結(jié)合miRNA,從而調(diào)控基因表達(dá)。
miRNA基因沉默過(guò)程中涉及的AGO2是將miRNA加工為成熟的沉默合體(miRISC)的關(guān)鍵蛋白。
① 驗(yàn)證circRNA與miRISC互作
·用anti-AGO2抗體進(jìn)行RIP-qPCR實(shí)驗(yàn),檢測(cè)AGO2與circRNA的結(jié)合;
·通過(guò)標(biāo)簽法體內(nèi)RNA pulldown實(shí)驗(yàn),Western Blot檢測(cè)pulldown產(chǎn)物中的AGO2,miRNA-seq分析產(chǎn)物中的miRNA。
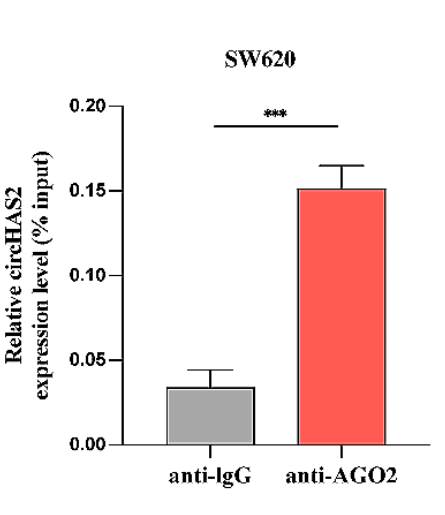
圖10 采用AGO2和IgG抗體進(jìn)行RIP檢測(cè)SW620細(xì)胞中AGO2與circHAS2的互作。[8]
② 驗(yàn)證circRNA與miRNA互作
·聯(lián)合miRNA-seq和circBank等數(shù)據(jù)庫(kù)預(yù)測(cè)circRNA互作的候選miRNA;
·FISH共定位及雙熒光素酶實(shí)驗(yàn)驗(yàn)證miRNA與circRNA的結(jié)合;
·轉(zhuǎn)染miRNA mimic或inhibitor到細(xì)胞中,驗(yàn)證miRNA的細(xì)胞功能。
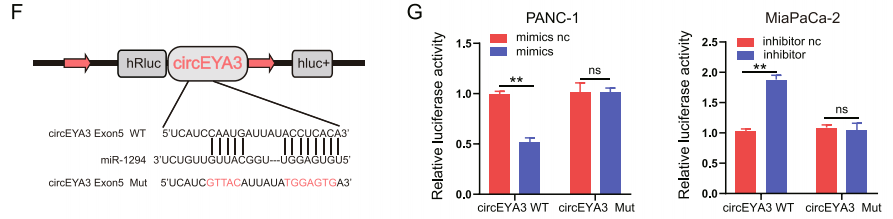
圖11 雙熒光素酶實(shí)驗(yàn)研究circEYA3與miR-1294互作。[9]
③ 研究miRNA的靶mRNA
·mRNA-seq和生信分析預(yù)測(cè)miRNA的靶mRNA;
·轉(zhuǎn)染miRNA mimic或inhibitor到細(xì)胞中,驗(yàn)證mRNA的表達(dá)量變化;
·雙熒光素酶實(shí)驗(yàn)驗(yàn)證miRNA和mRNA的結(jié)合。
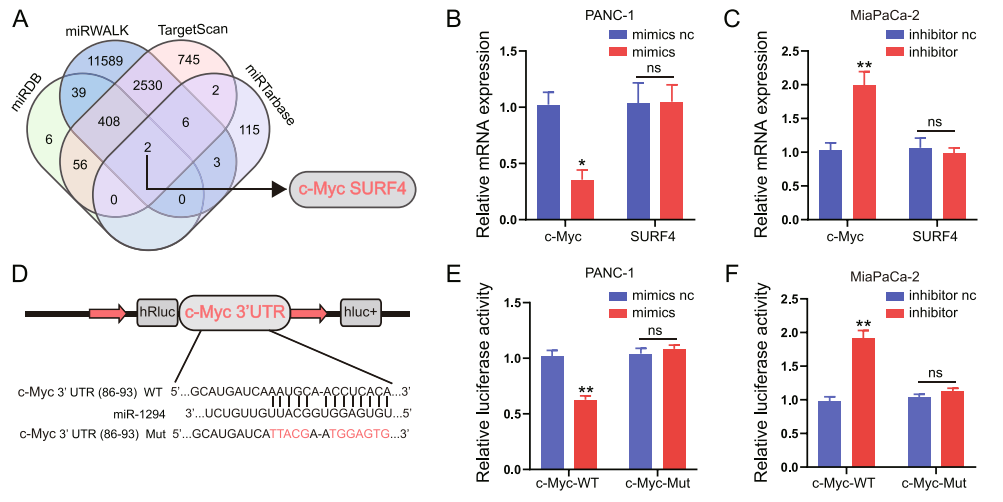
圖12 A:利用數(shù)據(jù)庫(kù)預(yù)測(cè)miR-1294的靶基因;B-C:轉(zhuǎn)染miR-1294 mimic或inhibitor,qRT-PCR檢測(cè)c-Myc和SURF4的表達(dá);D-F:雙熒光素酶實(shí)驗(yàn)驗(yàn)證miR-1294與c-Myc互作。[9]
④ 體外機(jī)制驗(yàn)證
·進(jìn)行挽救實(shí)驗(yàn),體外驗(yàn)證circRNA-miRNA-mRNA的相互作用機(jī)制。
(2)與蛋白互作影響蛋白功能
circRNA可作為支架,或蛋白sponge,調(diào)節(jié)蛋白之間的互作或蛋白的功能。
① circRNA pulldown聯(lián)合LC-MS/MS和Western Blot定性或定量分析circRNA互作的蛋白。
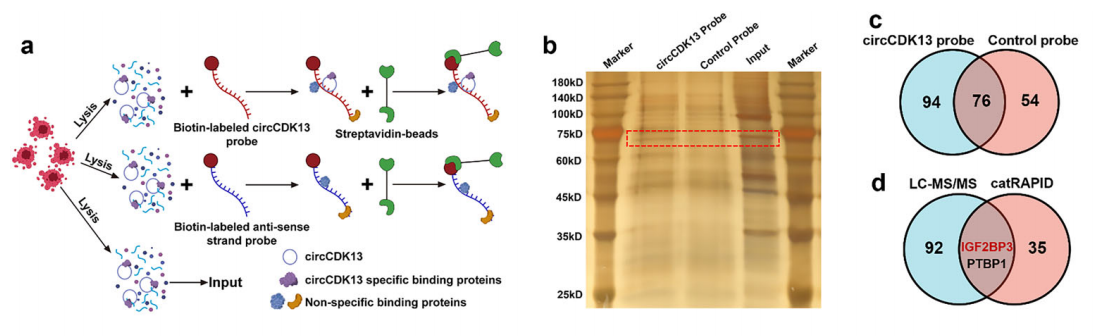

圖13 探針?lè)╟ircRNA pulldown聯(lián)合LC-MS/MS和Western Blot分析circCDK13互作的蛋白。[10]
②利用互作蛋白特異性抗體進(jìn)行RIP-qPCR反向驗(yàn)證蛋白與circRNA的互作。
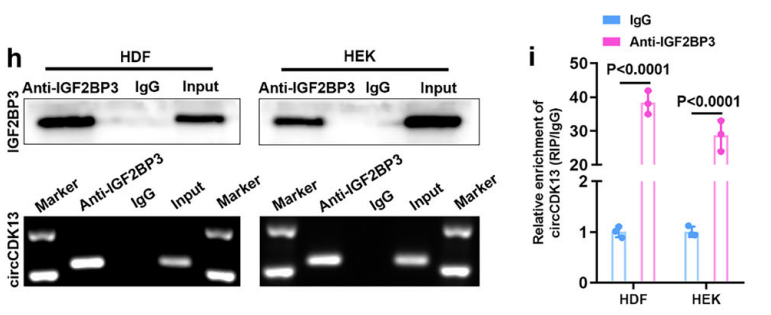
圖14 RIP驗(yàn)證circCDK13與IGF2BP3之間的相互作用。[11]
③ 免疫熒光結(jié)合熒光原位雜交(IF-FISH)可檢測(cè)circRNA和目標(biāo)蛋白細(xì)胞或組織中的互作情況。

圖15 IF-FISH檢測(cè)顯示circACTN4與FUBP1在乳腺癌細(xì)胞核中共定位。[11]
④ Co-IP實(shí)驗(yàn)可研究circRNA是否影響蛋白之間相互作用。
⑤ 通過(guò)細(xì)胞實(shí)驗(yàn)體外驗(yàn)證circRNA-蛋白互作機(jī)制。
(3)編碼蛋白
circRNA曾被認(rèn)為是“非編碼RNA”,后來(lái)陸續(xù)有研究證明circRNA可以編碼多肽或蛋白,并發(fā)揮特定的功能。
①驗(yàn)證編碼能力
·Ribo-seq或RNC-seq聯(lián)合生信分析可預(yù)測(cè)有翻譯或編碼可能性的circRNA及其ORF和IRES元件;
·構(gòu)建T系列載體,可進(jìn)一步驗(yàn)證circRNA的翻譯能力。
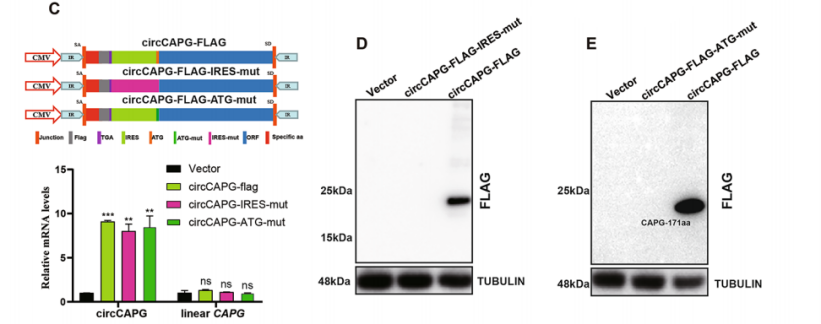
圖16 構(gòu)建T系列載體,驗(yàn)證circCAPG的編碼潛能。[12]
② 翻譯產(chǎn)物結(jié)構(gòu)分析
通過(guò)標(biāo)簽抗體或制備特異性抗體IP/Co-IP下拉翻譯產(chǎn)物,采用靈敏且快速掃描的LC-MS/MS結(jié)合Western Blot分技術(shù),定性或定量分析翻譯的產(chǎn)物。
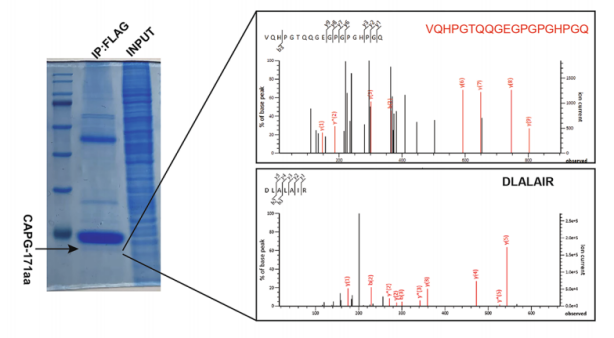
圖17 利用 FLAG抗體進(jìn)行IP,質(zhì)譜檢測(cè)circCAPG-FLAG中CAPG-171aa,并分析其氨基酸序列。[12]
③ 翻譯機(jī)制
典型IRES元件介導(dǎo):構(gòu)建R系列載體,可驗(yàn)證目的circRNA翻譯是否為典型IRES元件介導(dǎo),并驗(yàn)證IRES元件的活性。
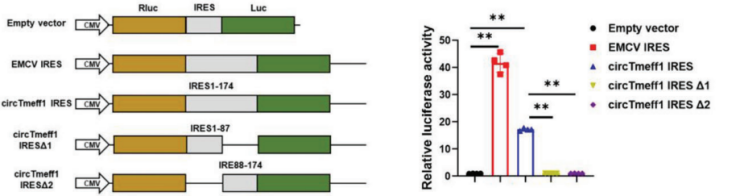
圖18 構(gòu)建R系列載體,驗(yàn)證circCAPG的IRES活性。[13]
m6A甲基化修飾介導(dǎo):MeRIP實(shí)驗(yàn)可分析目的circRNA是否存在m6A甲基化修飾。
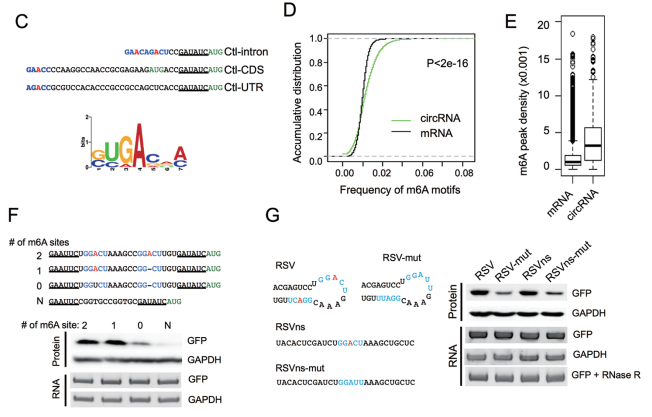
圖19 根據(jù)MeRIP-seq結(jié)果研究m6A介導(dǎo)circRNA翻譯。[14]
④ 翻譯產(chǎn)物功能驗(yàn)證
通過(guò)構(gòu)建circRNA過(guò)表達(dá)、翻譯產(chǎn)物過(guò)表達(dá)載體及相關(guān)突變載體,轉(zhuǎn)染細(xì)胞進(jìn)行細(xì)胞實(shí)驗(yàn)驗(yàn)證circRNA或翻譯產(chǎn)物的功能。
(4)調(diào)控轉(zhuǎn)錄
① circRNA pulldown-LC-MS/MS結(jié)合RIP可分析circRNA與轉(zhuǎn)錄相關(guān)蛋白的相互作用;
② 利用轉(zhuǎn)錄因子抗體進(jìn)行ChIP-seq,結(jié)合數(shù)據(jù)庫(kù)預(yù)測(cè)結(jié)果可篩選調(diào)控轉(zhuǎn)錄的靶基因;
③ 通過(guò)挽救實(shí)驗(yàn)可進(jìn)一步驗(yàn)證circRNA-轉(zhuǎn)錄相關(guān)蛋白-靶基因DNA之間的相互調(diào)控作用。
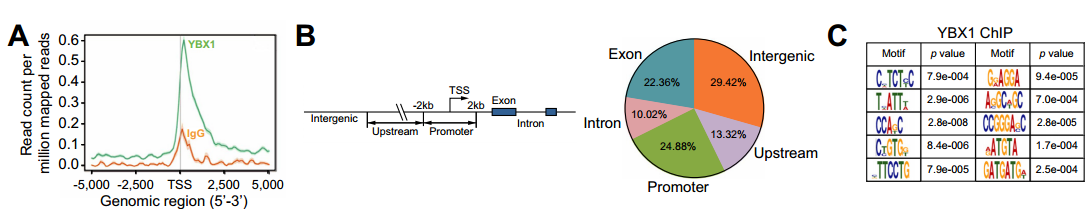
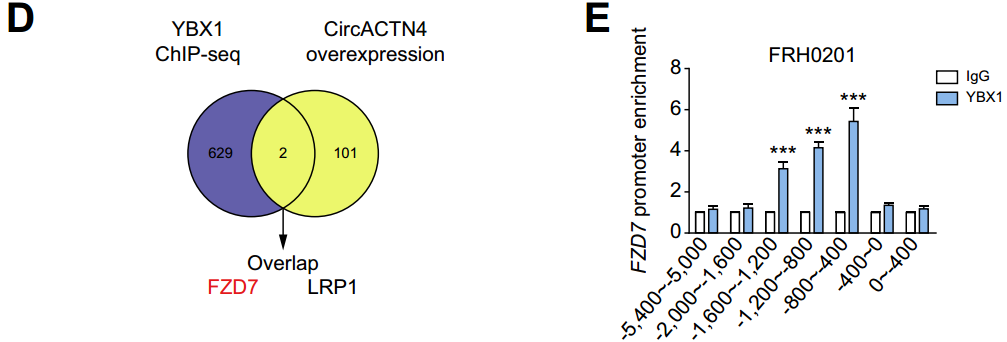
圖20 CircACTN4招募YBX1共同激活FZD7轉(zhuǎn)錄。A-C:利用ChIP-seq對(duì)FRH0201細(xì)胞中YBX1結(jié)合區(qū)域的全基因組分布進(jìn)行分析;D:聯(lián)合RNA-seq和ChIP-seq結(jié)果得到靶基因FZD7和LRP1;E:ChIP-qPCR檢測(cè)FRH0201細(xì)胞中FZD7啟動(dòng)子TSS - 1200 ~ - 800 bp區(qū)域YBX1富集增加。[15]
相關(guān)技術(shù)服務(wù)
機(jī)制研究:RIP-qPCR/RIP-seq、RNA pulldown-WB/LC-MS/MS、miRNA-seq、熒光素酶報(bào)告檢測(cè)、mimic/inhibitor、FISH/IF-FISH檢測(cè)、Co-IP、MeRIP-seq、ChIP-seq
相關(guān)產(chǎn)品

建立動(dòng)物模型,利用體外制備的LNP-circRNA或病毒載體給藥處理,驗(yàn)證circRNA在體內(nèi)的功能,對(duì)生理或病理的調(diào)控作用。
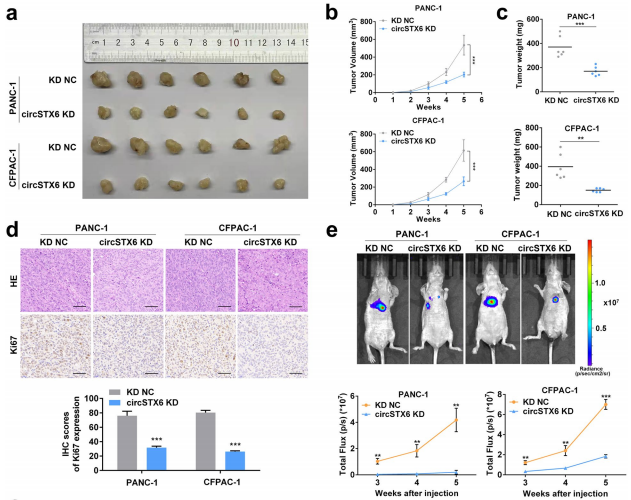
圖21 動(dòng)物模型驗(yàn)證CircSTX6在體內(nèi)的作用。[6]
相關(guān)技術(shù)服務(wù)
過(guò)表達(dá)/敲低:circRNA體外合成-LNP包封、circRNA過(guò)表達(dá)/干擾載體構(gòu)建及驗(yàn)證、慢病毒(LV)/腺相關(guān)病毒(AAV)包裝、穩(wěn)株構(gòu)建
案例文獻(xiàn):
[1] Liang L et al. ALKBH5-mediated m6A modification of circCCDC134 facilitates cervical cancer metastasis by enhancing HIF1A transcription. J Exp Clin Cancer Res. 2022, 41(1):261.
[2] van Heesch S et al. The Translational Landscape of the Human Heart. Cell. 2019, 178(1):242-260.e29.
[3] Zhang M et al. A peptide encoded by circular form of LINC-PINT suppresses oncogenic transcriptional elongation in glioblastoma. Nat Commun. 2018 , 9(1):4475.
[4] Wu Y et al. Circular RNA circCORO1C promotes laryngeal squamous cell carcinoma progression by modulating the let-7c-5p/PBX3 axis. Mol Cancer. 2020, 19(1):99.
[5] Yao B et al. The circSPON2/miR-331-3p axis regulates PRMT5, an epigenetic regulator of CAMK2N1 transcription and prostate cancer progression. Mol Cancer. 2022, 21(1):119.
[6] Meng L et al. CircSTX6 promotes pancreatic ductal adenocarcinoma progression by sponging miR-449b-5p and interacting with CUL2. Mol Cancer. 2022, 21(1):121.
[7] Kristensen LS et al. The biogenesis, biology and characterization of circular RNAs. Nat Rev Genet. 2019, 20(11):675-691.
[8] Li H et al. CircHAS2 activates CCNE2 to promote cell proliferation and sensitizes the response of colorectal cancer to anlotinib. Mol Cancer. 2024, 23(1):59.
[9] Rong Z et al. Circular RNA CircEYA3 induces energy production to promote pancreatic ductal adenocarcinoma progression through the miR-1294/c-Myc axis. Mol Cancer. 2021, 20(1):106.
[10] Huang Q et al. circCDK13-loaded small extracellular vesicles accelerate healing in preclinical diabetic wound models. Nat Commun. 2024, 15(1):3904.
[11] Wang X et al. The circACTN4 interacts with FUBP1 to promote tumorigenesis and progression of breast cancer by regulating the expression of proto-oncogene MYC. Mol Cancer. 2021, 20(1):91.
[12] Song R, et al. A novel polypeptide CAPG-171aa encoded by circCAPG plays a critical role in triple-negative breast cancer. Mol Cancer. 2023, 22(1):104.
[13] Chen R, et al. CircTmeff1 Promotes Muscle Atrophy by Interacting with TDP-43 and Encoding A Novel TMEFF1-339aa Protein. Adv Sci (Weinh). 2023, 10(17):e2206732.
[14] Yang Y, et al. Extensive translation of circular RNAs driven by N6-methyladenosine. Cell Res. 2017, 27(5):626-641.
[15] Chen Q et al. Circular RNA ACTN4 promotes intrahepatic cholangiocarcinoma progression by recruiting YBX1 to initiate FZD7 transcription. J Hepatol. 2022, 76(1):135-147.
板 1-01_20230822133930A020.png)
 購(gòu)物車
購(gòu)物車


 廣州市黃埔區(qū)開(kāi)源大道11號(hào)科技企業(yè)加速器A區(qū)6棟2樓
廣州市黃埔區(qū)開(kāi)源大道11號(hào)科技企業(yè)加速器A區(qū)6棟2樓


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn