- GENESEED

- 首頁
- >
- GENESEED
- >
circRNA如何調控轉錄?
環狀RNA(circRNA)調控靶基因的機制包括海綿吸附miRNA調控RNA穩定性或翻譯,與蛋白互作調控蛋白質功能,編碼蛋白發揮作用,與DNA或轉錄因子互作調控轉錄等。本期主要聊一聊circRNA的調控轉錄。
circRNA轉錄調控機制啟動子區域是轉錄調控中研究最廣泛的特定區域。circRNAs可以通過與RNA聚合酶II (Pol II)結合、募集蛋白質或形成R-loop靶向宿主基因的轉錄調控區域,從而正向或負向調節宿主基因的轉錄。
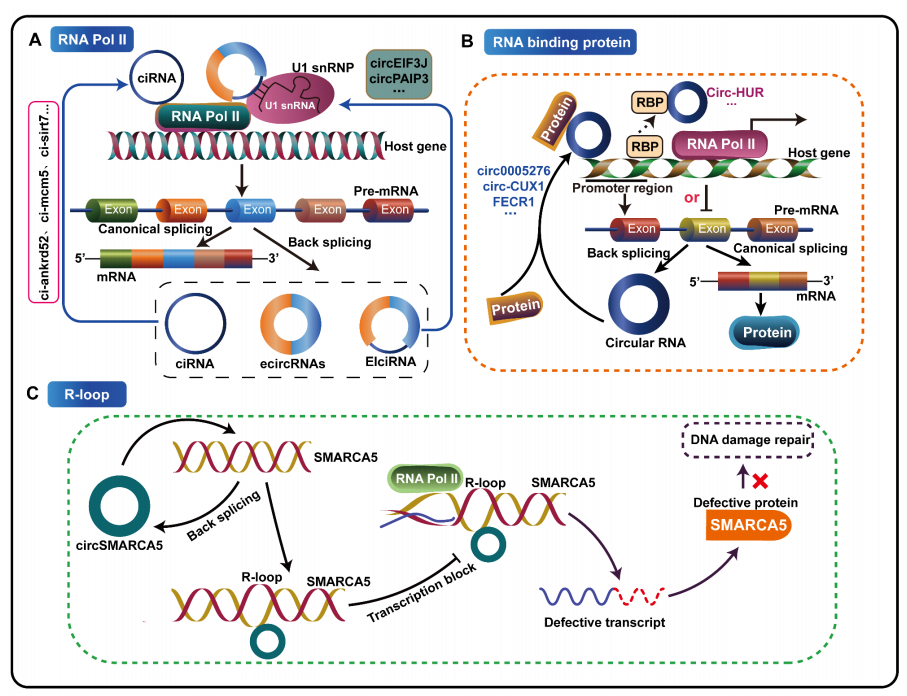
圖1 circRNAs在轉錄水平上調控宿主基因的表達。[1]
01結合poly II促進宿主基因的轉錄活性
ciRNA(內含子環狀RNA) ci-ankrd52、ci-mcm5和ci-sirt7主要富集于其宿主基因的轉錄位點,這些位點與RNA Pol II介導的轉錄延伸有關,是宿主基因的正向轉錄調控因子,可增強宿主基因的表達。[2]
circEIF3J和circPAIP2這兩個EIciRNA(外顯子-內含子環狀RNA)能與RNA Pol II、U1 snRNP和宿主基因啟動子互作,通過形成正反饋回路以順式作用方式增強宿主基因的轉錄水平。[3]
02招募蛋白質調節宿主基因的表達
某些circRNA上存在高度特異性的蛋白結合位點,可以作為蛋白質誘餌、支架和招募者,將單個或多個蛋白招募到靶啟動子的特定區域,從而調節宿主基因的轉錄激活和表達。這些蛋白質類型包括RNA結合蛋白(RBP)、DNA去甲基化酶和DNA甲基轉移酶。
募集蛋白激活宿主基因轉錄
circ-CUX1可與EWS RNA結合蛋白1 (EWSR1)結合,促進EWSR1與MYC相關鋅指蛋白(MAZ)互作,誘導MAZ的轉錄激活及宿主基因CUX1和其它相關基因的轉錄調控,從而促進有氧糖酵解和神經母細胞瘤的惡性進展。[4]
circRNA FECR1可通過招募DNA去甲基化酶TET1,結合宿主基因FLI1啟動子,誘導DNA去甲基化。此外,circRNA FECR1還結合并下調DNA甲基轉移酶DNMT1,誘導啟動子CpG島的低甲基化激活FLI1轉錄,從而促進乳腺癌細胞的侵襲能力。[5]
海綿吸附RBP抑制宿主基因的轉錄
circ-HUR與CCHC型鋅指核酸結合蛋白(CNBP)的RGG結構域相互作用,抑制其與HuR啟動子的結合,從而抑制HuR的轉錄,導致其宿主基因HuR下調,抑制體外和體內胃癌的生長和侵襲性。[6]
03形成R-loop調節宿主基因的表達
R-loop是一種特殊的染色質結構,由RNA-DNA雜交和被取代的單鏈DNA組成,通常由RNA聚合酶停頓或RNA生物發生功能障礙導致。R-loop可以干擾DNA的復制、修復和轉錄。circRNAs可通過DNA雜交或形成R-loop,提高同源外顯子缺陷mRNA的切割效率,這不僅影響線性轉錄物豐度,還產生mRNA陷阱,從而暫停轉錄和改善剪接因子。
怎么研究circRNA的轉錄調控?
看文獻,學思路↓↓↓
標題:hsa_circ_0007919 induces LIG1 transcription by binding to FOXA1/TET1 to enhance the DNA damage response and promote gemcitabine resistance in pancreatic ductal adenocarcinoma [7]
雜志:Molecular Cancer
單位:徐州醫科大學附屬醫院
PS:該研究中RIP試劑盒由吉賽生物提供
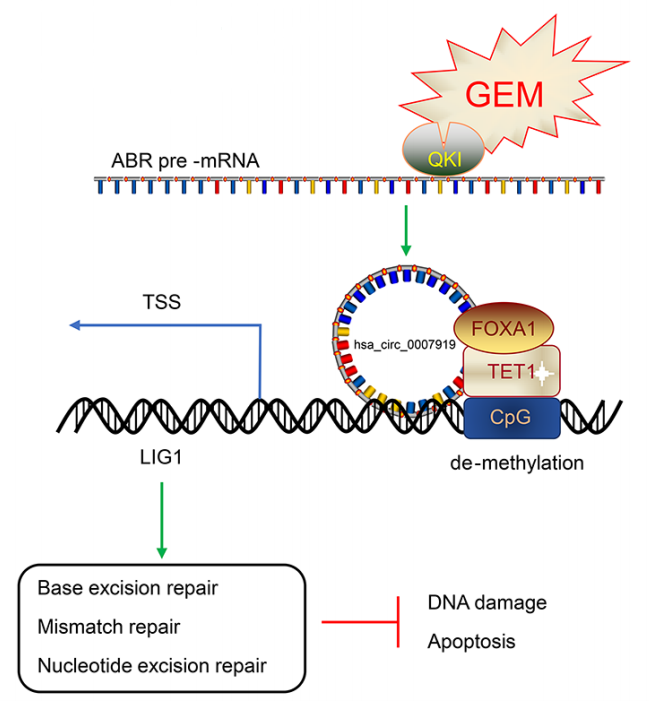
環狀RNA (circRNAs)在癌癥的發生發展和化療耐藥中發揮著重要作用。DNA損傷修復有助于癌細胞增殖和抵抗化療誘導細胞凋亡。研究鑒定出在耐吉西他濱(GEM)的胰腺導管腺癌(PDAC)組織和細胞中表達上調的 hsa_circ_0007919。hsa_circ_0007919招募FOXA1和TET1降低LIG1啟動子的甲基化并促進其轉錄,進一步促進堿基切除修復、錯配修復和核苷酸切除修復。Hsa_circ_0007919通過依賴LIG1的方式促進DNA損傷修復,從而促進GEM耐藥,維持細胞存活。
主要研究思路
NGS:hsa_circ_0007919在GEM耐藥PDAC組織中顯著上調
細胞實驗:hsa_circ_0007919調控細胞增殖/凋亡,及GEM的敏感性
RNA-seq:LIG1與hsa_circ_0007919表達呈正相關
細胞實驗:hsa_circ_0007919誘導LIG1表達,激活DNA損傷修復途徑,增強GEM耐藥
FISH/核質分離:hsa_circ_0007919主要分布在細胞核
circAtlas/SPP/STRING數據庫預測:FOXA1與hsa_circ_0007919/LIG1啟動子/TET1
蛋白互作
Co-IP實驗:FOXA1與TET1蛋白互作
RIP/ChIRP實驗:hsa_circ_0007919可與FOXA1和TET1結合
JASPAR/MethPrimer 2.0數據庫預測:FOXA1與LIG1啟動子CpG島區域互作
ChIP實驗:FOXA1和TET1與LIG1啟動子的-1273至-1411區域結合
熒光素酶報告基因實驗:hsa_circ_0007919通過結合FOXA1和TET1增強LIG1的轉錄
上述研究思路可見,研究circRNA或者其它RNA(如lncRNA)轉錄調控最關鍵的技術如下:
吉賽生物新產品Co-IP和ChIP試劑盒重磅來襲!!助力您輕松研究轉錄調控~
ChIP試劑盒
① 胞內反應:使用抗體免疫沉淀胞內蛋白-DNA復合物,真實反應細胞生理狀態;
② 流程簡便:操作簡便;
③ 時間周期短:整個實驗流程<8h。

Co-IP試劑盒
① 方便快捷:整個實驗流程<8h;
② 捕獲效率高,重復性高。

參考文獻
[1] Wei J, et al. Understanding the roles and regulation patterns of circRNA on its host gene in tumorigenesis and tumor progression. J Exp Clin Cancer Res. 2023;42(1):86.[2] Zhang Y, et al. Circular intronic long noncoding RNAs. Mol Cell. 2013;51(6):792-806.[3] Li Z, et al. Exon-intron circular RNAs regulate transcription in the nucleus. Nat Struct Mol Biol. 2015;22(3):256-64.[4] Li H, et al. Therapeutic targeting of circCUX1/EWSR1/MAZ axis inhibits glycolysis and neuroblastoma progression. EMBO Mol Med. 2019;11(12):e10835.[5] Chen N, et al. A novel FLI1 exonic circular RNA promotes metastasis in breast cancer by coordinately regulating TET1 and DNMT1. Genome Biol. 2018;19(1):218.[6] Yang F, et al. Circ-HuR suppresses HuR expression and gastric cancer progression by inhibiting CNBP transactivation. Mol Cancer. 2019;18(1):158.[7] Xu L, et al. hsa_circ_0007919 induces LIG1 transcription by binding to FOXA1/TET1 to enhance the DNA damage response and promote gemcitabine resistance in pancreatic ductal adenocarcinoma. Mol Cancer. 2023;22(1):195.

 購物車
購物車


 廣州市黃埔區開源大道11號科技企業加速器A區6棟2樓
廣州市黃埔區開源大道11號科技企業加速器A區6棟2樓


 geneseed@geneseed.com.cn
geneseed@geneseed.com.cn